Complicaties van een operatie
Alle operaties hebben een bepaald risico. Dat geldt dus ook voor een hersenbiopsie of een craniotomie. Algemene risico’s hebben te maken met de narcose die eventueel gegeven moet worden. Specifieke risico’s van de operatie (biopsie of craniotomie) zijn infectie gevaar (als er een bacterie in het operatiegebied terecht komt. Die bacterie kan “van buiten” komen (uit de omgevingslucht, via de operatie-instrumenten of via de operateur). De kans hierop is klein, omdat met steriele instrumenten en onder steriele omstandigheden wordt gewerkt. Meestal treedt een infectie op die is veroorzaakt door een bacterie van de patiënt zelf, bijvoorbeeld via de huid, uit diens longen, gebit, of via het bloed. Ook de kans daarop is uiterst klein. De kans op een infectie is wat groter bij patiënten die bepaalde medicijnen gebruiken tegen hersenzwelling (dexamethason). Dat middel heeft namelijk een remmende werking op de afweer tegen infecties. Daarom krijgen deze patiënten altijd antibiotica toegediend in het infuus, vlak voor de operatie.
Een ander risico van een operatie van de hersenen is het optreden van een bloeding binnen in de hersenen. Dat kan bij een biopsie tijdens de ingreep gebeuren (beschadiging van een bloedvaatje bij het nemen van een “hapje” uit de tumor), maar dat kan ook na de ingreep gebeuren (een zogenaamde na-bloeding in het operatiegebied). Een dergelijke bloeding kan zonder verschijnselen blijven, maar een enkele keer ook levensbedreigend zijn. In dat geval is een spoedoperatie noodzakelijk, om de bloeduitstorting te verwijderen, en de oorzaak van de bloeding te behandelen.
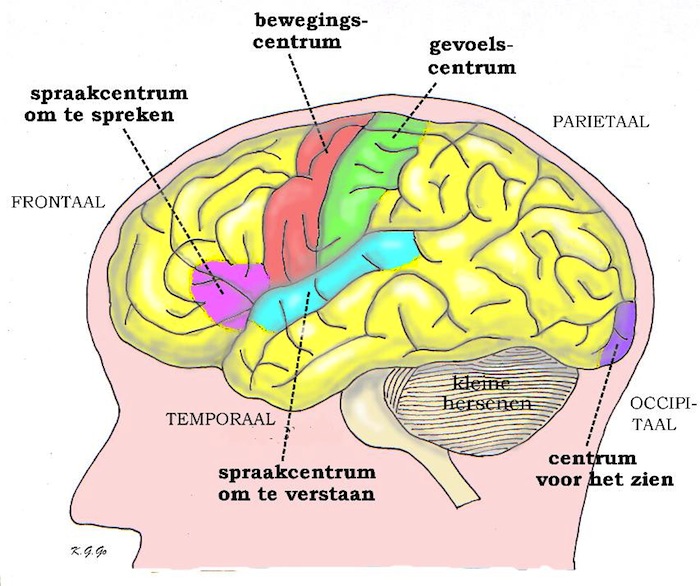
Bij het opereren in en bij de hersenen is het risico op beschadiging van de hersenen altijd aanwezig. De neurochirurg is opgeleid om ongewenste schade aan de hersenen te voorkomen, maar toch is het niet altijd mogelijk om beschadiging te vermijden. Wanneer de tumor zich in of zeer dicht bij belangrijke hersengebieden bevindt, kan het manipuleren in dat gebied ertoe leiden dat er na de operatie uitvalsverschijnselen zijn, die er tevoren niet in die mate waren. Meestal zijn die nieuwe uitvalsverschijnselen van voorbijgaande aard, en soms worden die veroorzaakt door zwelling van de hersenen (hersenoedeem). Herstel treedt dan vaak al snel na de operatie op, eventueel door toediening van medicijnen die gericht zijn tegen de zwelling.
Patiënten die voor operatie al last hadden van epilepsie hebben een iets verhoogde kans op een epileptische aanval na operatie van een hersentumor, ook als ze al medicijnen tegen de epilepsie slikken. Soms krijgt een patiënt na operatie een epilepsie-aanval, terwijl hij/zij daar voor operatie geen last van had. Vaak is dat van voorbijgaande aard. Een epilepsie aanval na operatie kan echter ook het gevolg zijn van een na-bloeding. Als men dat vermoeden heeft, zal voor de zekerheid een CT-scan worden gemaakt.
Een complicatie die ook kan voorkomen bij een hersenoperatie is lekkage van hersenvocht. De hersenen drijven als het ware in hersenvocht, en dat vocht komt vrij als het vlies rondom de hersenen wordt geopend. Als de operatie wordt beëindigd, moet het hersenvlies waterdicht gesloten worden, om te voorkomen dat het hersenvocht via de opening in het hersenvlies kan ontsnappen. Soms is het niet goed mogelijk lekkage van hersenvocht te vermijden. In dat geval zal een tijdelijke drain worden geplaatst in de schedel, of in de rug, om er voor te zorgen dat de druk van het hersenvocht kunstmatig laag wordt gehouden. Op die manier kan de operatiewond verkleven, en wordt lekkage via de wond voorkomen. Een dergelijke drain moet meestal enkele dagen blijven zitten, om het gewenste effect te bereiken.
Het gevaar van lekkage is dat een infectie kan optreden door op de huid aanwezige bacteriën. Dat zou kunnen leiden tot een hersenvliesontsteking. Een hersenvliesontsteking geneest meestal snel na behandeling met antibiotica.
Daarnaast zijn er de complicaties van algemene aard zoals trombose, longontsteking e.d.
Vervolgbehandeling
Niet iedereen die een glioom heeft, krijgt dezelfde behandeling. Dit heeft niets te maken met verschillen van mening tussen artsen. Artsen handelen volgens richtlijnen die ze met elkaar hebben afgesproken en die zijn gebaseerd op wetenschappelijk onderzoek. Ook is er geregeld overleg met specialisten uit verschillende disciplines in neuro-oncologiewerkgroepen. U mag er daarom op rekenen dat u altijd de best mogelijke behandeling krijgt, waar ook in Nederland.
Bij de keuze voor een behandeling spelen een aantal zaken een rol:
- het type glioom
- de mate van kwaadaardigheid (gradering)
- de plaats van de tumor in de hersenen
- de leeftijd en neurologische en lichamelijke conditie
Type glioom
Eerder hebben we uitgelegd dat er verschillende typen gliomen zijn. De typen die het meest voorkomen zijn astrocytomen en oligodendrogliomen (en een mengvorm van beide). Deze twee typen kunnen hooggradig en laaggradig zijn. Bij de keuze van de behandeling wordt gekeken naar het type tumor dat u hebt. Zo blijkt het glioblastoom (de meest kwaadaardige vorm van een astrocytoom) het beste te reageren op een combinatie van bestraling en chemotherapie.
Gradering
Bij gliomen speelt de mate van kwaadaardigheid van de tumor een grote rol. Die kwaadaardigheid wordt uitgedrukt in graden. De gradering van een hersentumor is belangrijk bij het bepalen van de behandeling en het doen van voorspellingen over het verloop van de ziekte. Hooggradige gliomen (HGG) groeien snel en komen veel eerder in aanmerking voor een behandeling dan laaggradige gliomen (LGG). Bij laaggradige gliomen wordt de laatste tijd na een operatie ook vaak intensieve behandeling voorgesteld, terwijl voorheen in eerste instantie vaak voor een afwachtend beleid werd gekozen. Studies hebben aangetoond date r een belangrijke overlevingswinst is te halen bij deze tumoren.
Plaats van de tumor in de hersenen
De plaats van de tumor kan heel bepalend zijn voor de keuze van de behandeling. Een tumor kan bijvoorbeeld zo diep liggen dat een operatie niet mogelijk is. Een tumor kan ook in de buurt van hersendelen liggen die van levensbelang zijn, waardoor de tumor slechts gedeeltelijk verwijderd kan worden.
Leeftijd en conditie
Bij zware en ingrijpende behandelingen, zoals chemotherapie of een operatie kan de leeftijd een doorslaggevende factor zijn. Behalve iemands leeftijd speelt de lichamelijke conditie een rol. Hoe beter die is, hoe groter de kans dat een behandeling door het lichaam wordt verdragen en hoe kleiner de kans dat er complicaties optreden. Ook de combinatie van de leeftijd met de tumor gradering is van invloed op de keuzes, want bij oudere patiënten (boven de 50 jaar) met een laaggradig glioom (LGG) is men eerder geneigd om toch na de operatie een aanvullende behandeling te geven, terwijl bij jonge patiënten met een LGG vaker voor een afwachten beleid (“watchful waiting”) werd gekozen.
Na operatie kunnen verschillende paden worden bewandeld. In grote lijnen zijn er bij een hersentumor drie hoofdbehandelingen: operatie, bestraling en medicijnen. Deze worden geregeld gecombineerd. De operatie is hierboven al besproken. Hieronder volgt een uiteenzetting over de radiotherapie en de chemotherapie.
Radiotherapie (“nabestraling”)
Bij radiotherapie wordt gebruik gemaakt van röntgenstraling met een hoge energie. Als deze stralen door weefsel worden gestuurd, veroorzaakt dat een reactie tussen de straling en het weefsel. Er wordt een fysische reactie veroorzaakt, gevolgd door een chemische reactie. Die chemische reactie zorgt ervoor dat stoffen vrijkomen (ionen en radicalen) die beschadiging veroorzaken van de cellen in de directe omgeving. Op deze manier kunnen tumorcellen (maar ook gezonde cellen) worden beschadigd (waardoor ze zich bijvoorbeeld niet meer kunnen vermenigvuldigen) of gedood. Normale cellen hebben echter het vermogen om beschadigingen te herstellen. Tumorcellen kunnen dat veel minder goed. Om te voorkomen dat door bestraling te veel gezonde cellen worden beschadigd, wordt bij bestraling de totale dosis over een groot aantal kleinere porties verdeeld. De bestraling wordt gespreid over een periode van vele dagen tot een aantal weken. Daardoor krijgen de normale weefsels de kans om tussentijds te “repareren”, terwijl de (kwetsbare) tumorcellen langdurig worden beschoten met schadelijke straling.
Chemotherapie
Bij chemotherapie wordt gebruik gemaakt van medicijnen (cytostatica) die de vermenigvuldiging van cellen afremmen. Cytostatica zijn er in verschillende vormen, b.v als tablet, maar er zijn ook middelen die via een injectie of in een infuus moeten worden toegediend. Een behandeling bestaat meestal uit één of meerdere kuren, al dan niet in combinatie met een bestralingsbehandeling. Welke cytostatica toegediend worden is afhankelijk van het type glioom. Dit is afhankelijk van uw reactie op de medicijnen (de bijwerkingen) en het effect op de tumor. De medicijnen kunnen ernstige bijwerkingen hebben. Wilt u in aanmerking komen voor chemotherapie dan moet uw lichaam in een goede conditie zijn. Het was gebruikelijk chemotherapie alleen te geven in geval van terugkerende tumorgroei (recidief tumor), maar deze aanpak is aan het veranderen. Bij sommige typen tumoren (bijvoorbeeld het glioblastoom) is het nuttig gebleken chemotherapie in een eerder stadium, en tegelijk met de bestraling, te geven.
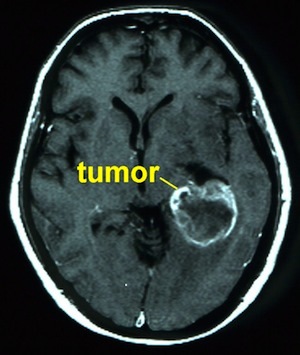
In de loop van de tijd kunnen ook aanpassingen van de behandeling noodzakelijk zijn. Een laaggradig glioom zal in de meeste gevallen in de loop van de tijd veranderen in een hooggradig glioom (dit heet “dedifferentiatie”). De tumor wordt dus agressiever. Om dat vast te stellen zal in de meeste gevallen een nieuwe operatie nodig zijn, waarbij materiaal wordt verwijderd dat door de patholoog zal worden vergeleken met het tumorweefsel dat bij de vorige operatie is onderzocht. Aanwijzingen dat een laaggradig glioom “onrustig” geworden is, zijn vaak op een controle MRI te zien: de tumor blijkt te zijn (aan)gegroeid, er is een verandering van het aspect (dus hoe de tumor er op de scan uitziet, bijvoorbeeld verhoging van de opname van het contrastmiddel). In andere gevallen bemerkt de patiënt zelf dat er dingen veranderen, bijvoorbeeld doordat er epilepsie optreedt (terwijl dat eerder niet zo was) of doordat er (nieuwe) uitvalsverschijnselen ontstaan. Dat kunnen tekenen zijn van verandering van de tumor, en zal aanleiding geven om een nader onderzoek te doen, en om uiteindelijk de behandelstrategie te veranderen.
Globaal behandelschema glioom
Bij verdenking op aanwezigheid van een laaggradig glioom (LGG):
- ofwel operatie:
- hersenbiopsie met weefseldiagnose LGG
- craniotomie met weefseldiagnose LGG + tumor verwijderen
- ofwel waakzaam afwachten’: watchful waiting (niet behandelen en afwachten met MRI controles hoe de tumor zich ontwikkelt). Indien daarna bij controle scans aangetoonde groei of aankleuring op de MRI-scan optreedt: biopsie of craniotomie.
Bij een LGG volgt de laatste tijd steeds vaker bestraling of chemotherapie.
Vervolgbehandeling: dit is aan de orde indien er sprake is van aangetoonde groei van een LGG. In de meeste gevallen zal dan allereerst een nieuwe weefseldiagnose worden gedaan, hetgeen betekent dat wederom een operatie nodig is (biopsie of craniotomie), om na te gaan of er nog steeds sprake is van een LGG, dan wel of er in de tussentijd verandering van de laaggradige tumor in een hooggradig glioom (HGG) is opgetreden (“maligne degeneratie”).
Bij verdenking op aanwezigheid van een hooggradig glioom (HGG)
- in principe altijd operatie:
- Hersenbiopsie met weefseldiagnose LGG: zie boven
- Hersenbiopsie met weefseldiagnose HGG
- Craniotomie met weefseldiagnose + tumor verwijderen LGG: zie boven
- Craniotomie met weefseldiagnose + tumor verwijderen HGG
Bij HGG, indien de conditie van patient het toestaat: behandeling bestaande uit bestraling, chemotherapie of een combinatie van beide.
Artsen werken volgens richtlijnen. Soms wijkt men van een richtlijn af. Hier kunnen verschillende redenen voor zijn, zoals de situatie van de patiënt, wetenschappelijk onderzoek of nieuwe inzichten.
Van een viertal factoren is bekend dat ze van invloed zijn op de levensverwachting: tumorgraad, leeftijd, functieverlies en de hoeveelheid tumor die operatief kan worden verwijderd. Sommige van deze factoren zijn niet te beïnvloeden, zoals duidelijk is voor tumorgraad en leeftijd. Graad II tumoren hebben een betere prognose dan de graad III en die weer beter dan de graad IV gliomen. Ook is bekend, dat patiënten jonger dan 50 jaar een betere prognose hebben. Hoe verder boven de 50 jaar, hoe ongunstiger de verwachtingen zijn. En patiënten die in een goede algemene conditie zijn en bijvoorbeeld nog in staat zijn tot werken, hebben een betere prognose dan de patiënten die geestelijk en/of lichamelijk veranderd zijn en hulp nodig hebben voor algemene dagelijkse zaken als wassen, aankleden, boodschappen doen, koken en eten.
Wel lijkt het zo dat hoe meer tumorweefsel bij een operatie verwijderd kan worden, hoe beter het is. Vergeleken met een op het oog complete verwijdering is het ongunstig als alleen een biopsie voor de weefseldiagnose mogelijk is. De plek in de hersenen – en de mogelijkheid om risicoarm te opereren – is doorslaggevend voor de aard van een operatie. De ongunstigste categorie (graad IV, oudere leeftijd, niet meer zelfstandig functionerend, alleen biopsie) heeft een levensverwachting van minder dan een jaar. Jonge mensen met een laaggradige tumor kunnen jarenlang (vrijwel) zonder neurologische problemen leven en normaal werken. Als de tumor gaat ontaarden naar een slechtere graad verandert het toekomstperspectief.
Tenslotte
Een hersentumor is een zeer ernstige diagnose. Ondanks een meer gunstig beloop bij de laaggradige astrocytomen en de oligodendrogliomen gaat het bij de kwaadaardige vorm (het glioblastoom of astrocytoom graad IV) om een aandoening met een vrijwel altijd fatale afloop binnen een of twee jaar. Ondanks alle vooruitgang in de neurochirurgie bestaat er geen effectieve therapie, niet in Nederland en ook niet elders op de wereld. Alle therapie is er allen op gericht om de patient zo lang mogelijk en met zo min mogelijk bijwerkingen te laten overleven. Genezing is niet mogelijk. De patiënten overlijden doorgaans aan een recidief met verhoging van de druk in het hoofd, leidende tot toenemende sufheid en neurologische uitval. Deze laatste fase is door de ontluistering en het verlies van contact voor de omgeving akeliger dan voor de patiënt zelf, die er doorgaans geen weet meer van heeft. Een patiënt voelt geen pijn en slaapt doorgaans heel rustig in. Tijdelijk worden nog wel medicijnen (steroïden) gegeven, maar na enige tijd werken deze niet meer. Een verstandig arts zal zijn patiënten en hun familie dan ook adviseren af te zien van het zoeken naar allerlei “laatste strohalm” behandelingen en zich erop te richten het resterende leven zo aangenaam en makkelijk mogelijk te maken. Onderzoek naar betere behandelingen wordt op veel plaatsen verrricht en men hoopt dat er net als bij andere tumoren een doorbraak zal plaatsvinden. Ook in Isala wordt bij lopende onderzoeken aangesloten om waar mogelijk een bijdrage te leveren aan de vooruitgang van de behandeling van patienten met een hersen tumor. De neuro-oncologie werkgroep van Isala vergadert regelmatig samen met collegae uit de ziekenhuizen in Apeldoorn, Deventer en Zutphen over patiënten met een hersentumor en de behandelmogelijkheden. Patiënten die in Isala worden behandle worden begeleid door een gespecialiseerd verpleegkundige neuro-oncologie.